Starzenie się jest procesem naturalnym, nieuchronnym i dotyczy niemal każdego żywego organizmu. Jest również zjawiskiem bardzo złożonym, obejmującym zmiany na poziomie organizmu jako całości, zmiany narządów, tkanek, ale także poszczególnych komórek. Starzejące się komórki posiadają szereg cech, których precyzyjna identyfikacja i zrozumienie pozwoli opracować strategie mające na celu spowolnienie procesu starzenia i podniesienie jakości życia osób starszych.
Starzenie się jest definiowane jako postępująca utrata integralności fizjologicznej organizmu, czemu towarzyszy pogorszenie jego funkcji oraz zwiększenie podatności na choroby. Jako, że starzenie się nie jest równoznaczne z wystąpieniem choroby, badacze starają się określić charakterystyczne cechy tego procesu. Stąd też zarówno biogerontologia, czyli nauka o biologicznym starzeniu się, jak i medycyna przeciwstarzeniowa stanowią intensywnie rozwijane dyscypliny naukowe. Poznanie mechanizmów odpowiedzialnych za starzenie i długość życia otwiera drogę do opracowywania metod zabezpieczających życie w zdrowiu i umożliwiających nie tylko wydłużenie czasu życia, ale także podniesienie jego jakości.
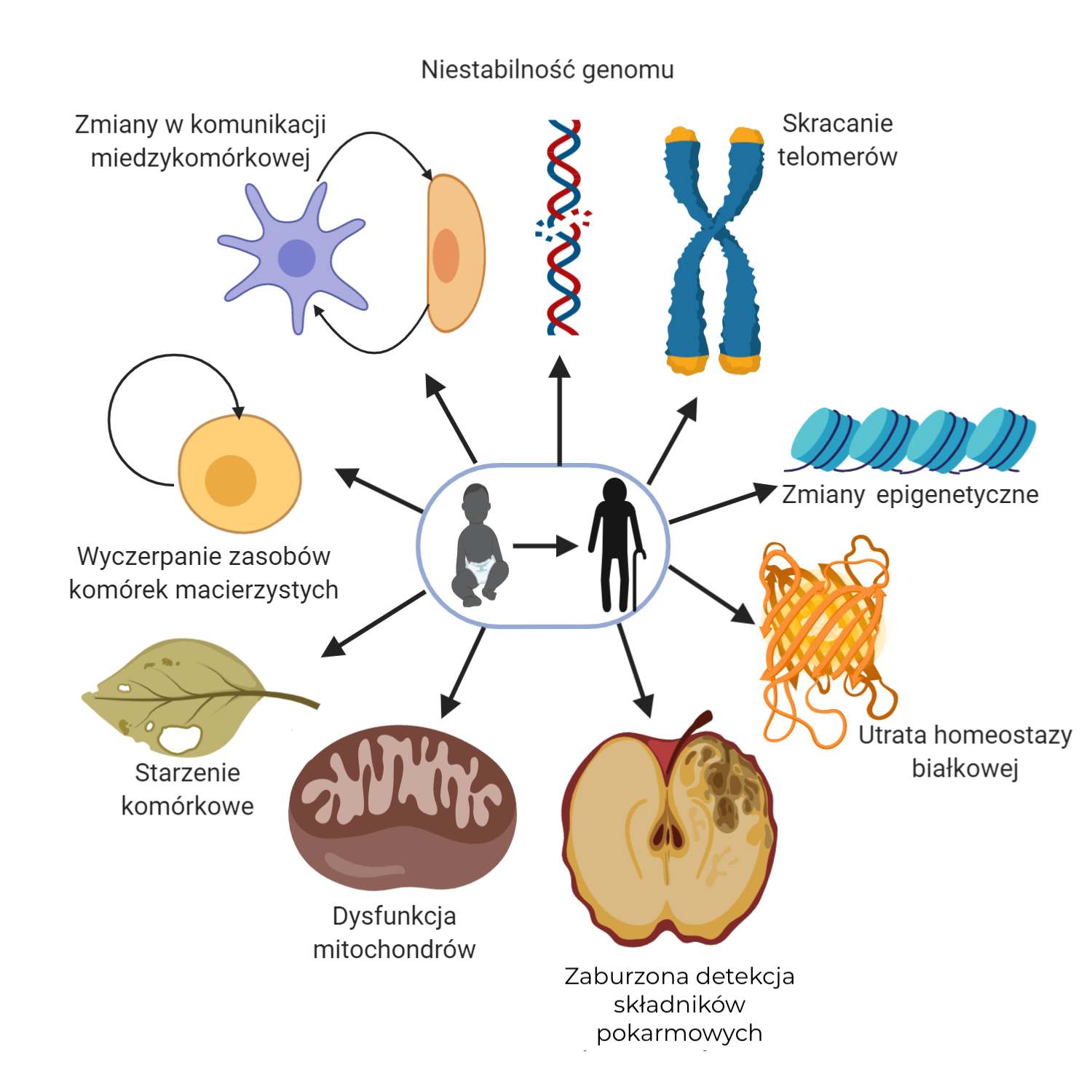
Proces starzenia się jest zjawiskiem bardzo złożonym, może być rozpatrywany na wielu płaszczyznach: populacji, organizmów indywidualnych, na poziomie narządów, tkanek oraz danych typów komórek. Starzenie przebiegające na poziomie komórkowym jest jednym z najlepszych modeli badań tego zjawiska, gdyż pozwala na dogłębne zbadanie zależności molekularnych zachodzących na poziomie makrocząsteczek, umożliwia również określenie wpływu danych czynników (na przykład środowiskowych czy manipulacji genetycznych) na powstawanie zmian mogących stanowić bezpośrednią przyczynę lub skutek procesu starzenia. Zaproponowano zatem dziewięć cech charakterystycznych dla procesu starzenia na poziomie komórkowym:
1. Niestabilność genomu
Zachowanie stabilności i integralności genomu warunkuje zdrowie i prawidłowe funkcjonowanie człowieka. Wraz z wiekiem dochodzi do akumulacji uszkodzeń DNA, co jest wynikiem działania zewnętrznych czynników chemicznych, fizycznych i biologicznych, jak również czynników endogennych, takich jak błędy w replikacji DNA czy podwyższone stężenie reaktywnych form tlenu. Zaburzenia te dotyczą zarówno DNA jądrowego, jak i mitochondrialnego. Wraz z wiekiem pogłębiają się zaburzenia mechanizmów naprawczych DNA, co prowadzi do nagromadzenia mutacji oraz zmian w liczbie i strukturze chromosomów. Komórki niosące takie zmiany, o ile nie zostaną w porę wyeliminowane, zagrażają homeostazie tkanki i całego organizmu. Dotyczy to w szczególności prawidłowego funkcjonowania komórek macierzystych, odpowiedzialnych za procesy odnowy tkanek.
2. Skracanie telomerów
Telomery są strukturami wchodzącymi w skład chromosomów, zbudowanymi z powtarzalnych sekwencji DNA. Te ułożone tandemowo odcinki DNA, wraz z wyspecjalizowanym kompleksem białkowym – szelteryną, chronią chromosomy przed degradacją i ewentualną fuzją. Ich obecność warunkuje utrzymanie integralności genomu, gdyż zabezpieczają one kodujące sekwencje DNA przed nieodwracalną utratą podczas replikacji. Wraz z wiekiem telomery ulegają skracaniu, co stanowi sygnał do zatrzymania podziałów komórkowych, indukcji starzenia i apoptozy. Stwierdzono, że do postępującego skracania telomerów przyczynia się długotrwała ekspozycja na czynniki stresogenne, w szczególności stres oksydacyjny.
3. Zmiany epigenenetyczne
Niewykluczone, że w procesie starzenia oraz regulacji długości życia większą rolę od czynników genetycznych odgrywają czynniki epigenetyczne. Epigenetyka zajmuje się badaniem przekazywania informacji genetycznych, które zachodzą bez zmian w sekwencji DNA i które są tkankowo specyficzne. Określone modyfikacje epigenetyczne wpływają na procesy rozwoju, różnicowania, pojawienie się patologii i są zależne od wpływu środowiska. Wraz z wiekiem zmianie ulegają profile epigenetyczne obejmujące metylację DNA, potranslacyjne modyfikacje histonów i remodeling chromatyny, co pociąga za sobą zmiany w ekspresji określonych genów.
4. Utrata homeostazy białkowej
Każda komórka posiada złożone mechanizmy zapewniające utrzymanie homeostazy jej białek. Mechanizmy te kontrolują utrzymanie stabilności białek o prawidłowej strukturze oraz degradację uszkodzonych, nieprawidłowo sfałdowanych białek w lizosomach czy proteasomie, co zapobiega ich akumulacji w komórce. Tak zwana proteostaza (ang. proteostasis) jest kluczowa dla prawidłowego funkcjonowania organizmu, a jej naruszenie, postępujące wraz z wiekiem, prowadzi do rozwoju chorób. Przykładowo, chroniczna synteza białek nieprawidłowo sfałdowanych, jak również ich agregacja i akumulacja, jest charakterystyczna dla choroby Parkinsona, Alzheimera czy zaćmy.
5 . Zaburzona detekcja składników pokarmowych
Poszukiwania genów, związanych ze starzeniem i długowiecznością u zwierząt, ujawniły związek pomiędzy długością ich życia a ścieżką hormonu wzrostu (GH)/insulina/insulino-podobny czynnik wzrostu (IGF-1), odpowiedzialną za informowanie komórek o obecności glukozy. Zastosowane genetyczne manipulacje osłabiające intensywność oddziaływania komponentów tej ścieżki sygnalizacyjnej znacząco wydłużały czas życia badanych zwierząt. Stwierdzono, że restrykcje kaloryczne, rozumiane jako ograniczenie dostarczania organizmowi kalorii w stosunku do zapotrzebowania o 30-40%, przy jednoczesnym zachowaniu wszystkich niezbędnych składników pokarmowych, wydłużają czas życia, obniżają częstość zachorowania i opóźniają wystąpienie chorób związanych z wiekiem, takich jak cukrzyca czy nowotwory u ssaków. Prowadzone są intensywne badania nad związkiem ścieżek sygnalizacyjnych odpowiedzialnych za detekcję poziomu aminokwasów czy stanów niskoenergetycznych komórki, a starzeniem i długością życia.
6. Dysfunkcja mitochondriów
Mitochondria izolowane z tkanek zwierzęcych i ludzkich wykazują zależne od wieku zaburzenia funkcjonowania, wzrost uszkodzeń oksydacyjnych, upośledzenie funkcji łańcucha oddechowego, zmiany wartości potencjału membranowego oraz zmiany w wiązaniu jonów wapnia. Wraz z wiekiem następuje akumulacja uszkodzonych mitochondriów, gdyż osłabieniu ulegają mechanizmy komórkowe odpowiedzialne za usuwanie i degradację mitochondriów, takie jak mitofagia czy makro-autofagia. W DNA mitochondrialnym kumulują się mutacje i delecje. Nieprawidłowo funkcjonujące mitochondria mogą mieć bezpośredni wpływ na sygnalizację komórki oraz komunikację między jej organellami.
7 . Starzenie komórkowe
W sytuacji, gdy uszkodzone komórki stwarzają potencjalne zagrożenie dla organizmu, podlegają jednemu z dwóch nieodwracalnym mechanizmów: apoptozie, czyli zaprogramowanej i podlegającej kontroli śmierci komórki lub przekształceniu w komórki senescentne. W komórkach senescentnych permanentnemu zatrzymaniu ulega cykl rozwoju komórkowego, stają się one niezdolne do podziałów, zachowują jednak zdolności wydzielnicze i wytwarzają specyficzne mikrośrodowisko, oddziałując na sąsiednie komórki. Starzenie komórkowe nie zachodzi we wszystkich tkankach w równym stopniu. Oba mechanizmy, apoptoza i starzenie komórkowe, chronią organizm przed nagromadzeniem uszkodzonych lub niechcianych komórek, stanowiąc zasadnicze zabezpieczenie przed procesem nowotworzenia. Wraz z wiekiem wzrasta liczba komórek senescentnych, w wyniku osłabionej zdolności organizmu do ich usuwania i/lub zwiększonego tempa ich generowania. Nie można jednak jednoznacznie stwierdzić, czy starzejemy się, bo starzeją się nasze komórki, czy starzenie komórkowe towarzyszy starzeniu naszego organizmu.
8. Wyczerpanie zasobów komórek macierzystych
Komórki macierzyste są obecne w większości tkanek dorosłych ssaków. Odpowiadają za utrzymanie homeostazy, czyli stanu równowagi tych tkanek, pośredniczą w procesach naprawczych i regeneracji w odpowiedzi na uszkodzenie. Zdolności regeneracyjne organizmu zmniejszają się wraz z wiekiem, zachwianiu ulega homeostaza. Pojawiające się wraz z wiekiem siwizna, utrata włosów, spadek masy i siły mięśniowej, spowolnienie gojenia się ran, zmiany w morfologii krwi czy osłabienie neurogenezy odzwierciedlają spadek zdolności regeneracyjnych komórek macierzystych. Wraz z wiekiem zmniejsza się liczba nerwowych komórek macierzystych, spada produkcja nowych neuronów, co prowadzi do upośledzenia funkcji poznawczych mózgu. Starzenie się komórek macierzystych z jednej strony stanowi niewątpliwą przyczynę starzenia się organizmu, z drugiej zaś przeciwdziała ich transformacji nowotworowej. Nowotworowe komórki macierzyste, tak jak prawidłowe komórki macierzyste, posiadają zdolność do samoodnowy i różnicowania. Fakt ten, jak również dowody pośrednie, mogą sugerować, iż nowotworowe komórki macierzyste wywodzą się z prawidłowych komórek macierzystych.
9. Zmiany w komunikacji międzykomórkowej
Oprócz zmian zachodzących w poszczególnych komórkach, starzeniu towarzyszą także zaburzenia komunikacji międzykomórkowej, zarówno na poziomie hormonalnym, jak i nerwowym. Najbardziej znaczące zdaje się być zjawisko występowania chronicznych, niespecyficznych stanów zapalnych o niskim nasileniu, bez oznak infekcji, prowadzących do uszkodzenia i degradacji tkanki. Tak zwany fenomen 'inflammaging' może być wynikiem obniżenia zdolności układu immunologicznego do usuwania patogenów i dysfunkcjonalnych komórek gospodarza, akumulacji uszkodzeń komórek, zaburzonej autofagii oraz sekrecji cytokin prozapalnych przez komórki senescentne. Związane z wiekiem zmiany w jednej tkance mogą prowadzić do deterioracji w innych tkankach, przykładowo komórki senescentne indukują starzenie w komórkach sąsiednich. Odwrotnie, manipulacje mające na celu zwiększenie długości życia jednej tkanki mogą opóźnić proces starzenia w innej.
Proces starzenia się jest zjawiskiem wielowymiarowym i złożonym już na poziomie komórkowym, a jego całkowite zrozumienie wciąż stanowi duże wyzwanie dla świata nauki. Ostateczne zdefiniowanie cech starzejących się komórek pozwoliłoby zbudować podstawę do dalszych badań nad molekularnymi mechanizmami starzenia się, a w konsekwencji zaprojektować odpowiednie interwencje wydłużające życie w zdrowiu.
Literatura:
- Lopez-Otin C, Blasco M. A, Partridge L, Serrano M, Kroemer G. The Hallmarks of Aging. Cell 2013; 153: 1194 – 1217.
- Mikuła-Pietrasik J, Niewiarowska A, Książek K. Święty Graal biologii, czyli jak i dlaczego się starzejemy? Post Bioch 2015; 61, 4: 344 – 355.
- Sosińska P, Mikuła-Pietrasik J, Książek K. Molekularne podstawy komórkowego starzenia: fenomen Hayflicka 50 lat później. Postepy Hig Med Dosw (online), 2016; 70 : 231 – 242.
- Armanios M. Telomeres and age-related disease: how telomere biology informs clinical paradigms. The Journal of Clinical Investigation 2013; 123: 996 – 1002.
- Sikora E. Starzenie i długowieczność. Post Bioch 2014; 60, 2: 125-137.
- Katsnelson A, De Strooper B, Zoghbi H.Y. Neurodegeneration: From cellular concepts to clinical applications. Sci. Transl. Med. 2018; 8.
- Anisimov V. A, Bartke A. The key role of growth hormone–insulin–IGF-1 signaling in aging and cancer. Critical Reviews in Oncology/Hematology 2013; 87: 201–223.
- Lautrup S, Sinclair D. A, Mattson M. P, Fang E. F. NAD+ in brain aging and neurodegenerative disorders. Cell Metabolism 2019; 30, 4: 630 – 655.
- Da Silva-Álvarez S, Picallos-Rabina P, Antelo-Iglesias L, Triana-Martínez F, Barreiro-Iglesias A, E Sánchez L, Collado M. The development of cell senescence. Experimental Gerontology 2018. https://doi.org/10.1016/j.exger.2019.110742.
- Bielak-Żmijewska A, Grabowska W, Przybylska D. Rola starzenia komórkowego w starzeniu organizmu i chorobach związanych z wiekiem. Postępy Biochemii 2014; 60, 2: 147 – 160.
- Liu L, Rando T. A. Manifestations and mechanisms of stem cell aging. J. Cell Biol. 2011; 193, 2: 257–266.
- Waś H, Czarnecka J. Komórki macierzyste a starzenie. Postępy Biochemii 2014; 60, 2: 161 – 176.
- Salminen A, Kaarniranta K, Kauppinen A. Inflammaging: disturbed interplay between autophagy and inflammasomes. AGING 2012; 4, 3: 167 – 175.
Średnia ocena: 5.00

